Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
Баллы, полученные вами за выполненные задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1–А30) поставьте знак « × » в клеточку, номер которой соответствует номеру выбранного вами ответа.
A1 Элемент, электронная конфигурация атома которого 1s22s22p63s23p2, образует водородное соединение
1) CH4 2) SiH4 3) H2O 4) H2S
A2 В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li → Be → B → C
2) Ar → Cl → S → P
3) Si → Al → Mg → Na
4) Ne → F → O → N
A3 Основные свойства наиболее выражены у оксида
1) бериллия
2) магния
3) алюминия
4) калия
A4 Соединения состава Na2ЭО4 образует каждый из двух элементов:
1) сера и хлор
2) сера и хром
3) хром и азот
4) фосфор и хлор
A5 Ковалентная неполярная связь характерна для каждого из двух веществ:
1) водорода и хлора
2) воды и алмаза
3) меди и азота
4) брома и метана
A6 Азот проявляет степень окисления + 3 в каждом из двух соединений:
1) N2O3 и NH3
2) NH4Cl и N2O
3) HNO2 и N2H4
4) NaNO2 и N2O3
1) атомную
2) металлическую
3) ионную
4) молекулярную
A8 В перечне веществ:
А) СH4
Б) H2S
В) СH3COOH
Г) NH3
Д) H5IO6
Е) K2HPO4
к классу кислот относятся
1) АБВ
2) БBД
3) БГД
4) ВДЕ
A9 Химическая реакция протекает между
1) Cu и ZnCl2 (р-р)
2) Zn и CuSO4 (р-р)
3) Fe и Al(NO3)3 (р-р)
4) Ag и FeSO4 (р-р)
1) гидроксидом кальция
2) хлоридом меди (II)
3) оксидом серы (VI)
4) оксидом хрома (VI)
1) HCl и NaNO3
2) HNO3 и Ba(OH)2
3) KOH и NaCl
4) NaOH и CaCO3
1) нитратом кальция
2) оксидом магния
3) оксидом углерода (II)
4) хлоридом натрия
1) X – H2 и Y – H2SO4(конц.)
2) X – C и Y – Na2SO4(р-р)
3) X – Cu и Y – H2SO4(разб.)
4) X – Al и Y – H2SO4(разб.)
1) СН2 = СН – СН2 – СН3
2) СН3 – СН = СН – СН3
3) СН3 – СН = СН2
4) СН2 = СН2
1) пропан
2) метанол
3) этан
4) бутен-1
А. Фенол взаимодействует с бромной водой.
Б. Фенол проявляет только основные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
1) NaОН и СО2
2) NaОН и Na2СO3
3) С2Н4 и С2Н5ОН
4) CO и С2Н5ОН
1) бутанола-1
2) бутановой кислоты
3) бутена-1
4) бутанола-2
1) пентана с гидроксидом натрия
2) пентена-1 с водой
3) пентаналя с водородом
4) 1-хлорпентана с гидроксидом меди (II)
1) CH3Cl
2) CH3CHO
3) H3C – O – CH3
4) HCHO
1) соединения, экзотермическим
2) замещения, экзотермическим
3) обмена, эндотермическим
4) соединения, эндотермическим
1) понижение давления
2) уменьшение концентрации Cl2
3) охлаждение системы
4) повышение температуры
1) увеличения концентрации водорода
2) повышения температуры
3) повышения давления
4) использования катализатора
1) хлорида калия
2) нитрата железа (III)
3) сульфата алюминия
4) карбоната натрия
1) NaOH
2) HCl
3) Ba(OH)2
4) NH3
1) нитрата бария
2) силиката калия
3) сульфата натрия
4) хлорида алюминия

А. Растворы мыла имеют щелочную среду.
Б. Водные растворы мыла не теряют моющих свойств в жесткой воде.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
1) стирола
2) этилена
3) бутена-2
4) изопрена
1) 20 л
2) 5 л
3) 50 л
4) 25 л
Ответом к заданиям этой части (В1–В10) является последовательность цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки.
Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
В заданиях В1–В5 к каждому элементу первого столбца подберите соответствующий элемент второго и запишите в таблицу выбранные цифры под соответствующими буквами, а затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов и каких-либо дополнительных символов. (Цифры в ответе могут повторяться.)
В1 Установите соответствие между молекулярной формулой вещества и классом органических соединений, к которому оно относится.
|
МОЛЕКУЛЯРНАЯ ФОРМУЛА
A) C4H6
Б) C4H8O2 В) C7H8 Г) C5H10O5 |
КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) углеводы
2) арены
3) алкины
4) сложные эфиры
5) альдегиды
|
|
УРАВНЕНИЕ РЕАКЦИИ
А) H2S + I2 = S + 2HI
Б) 2S + С = СS2 В) 2SO3 + 2KI = I2 + SO2 + K2SO4 Г) S + 3NO2 = SO3 + 3NO |
ОКИСЛИТЕЛЬ
1) I22) SO3 3) S 4) HI 5) H2S 6) NO2 |
|
ФОРМУЛА СОЛИ
А) CuSO4
Б) K2S В) BaCl2 Г) Pb(NO3)2 |
ПРОДУКТ НА АНОДЕ
1) азот
2) сера 3) хлор 4) металл 5) кислород 6) водород |
|
НАЗВАНИЕ СОЛИ
A) хлорид цинка
Б) сульфид калия В) нитрат натрия Г) нитрат меди |
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) не гидролизуется
|
|
НАЗВАНИЕ ВЕЩЕСТВА
A) алюминий
Б) кислород В) сера Г) натрий |
РЕАГЕНТЫ
1) Fe2O3, HNO3(р-р), NaOH(р-р)
2) Fe, HNO3, H2
3) HI, Fe, P2O3
4) C2H2,H2O,Cl2
5) CaCl2, KOH, HCl |
1) протекает по правилу В.В. Марковникова
2) приводит к образованию 2-бромпропана
3) относится к реакциям замещения
4) не сопровождается разрывом π-связи
5) осуществляется по ионному механизму
6) приводит к образованию 2,2-дибромпропана
В7 Ацетальдегид взаимодействует с
1) H2
2) CH4
3) HBr
4) CH3OH
5) C6H5NO2
6) Cu(OH)2
В8 В отличие от сахарозы, глюкоза
1) реагирует с кислородом
2) реагирует с серной кислотой (конц.)
3) восстанавливается водородом
4) окисляется аммиачным раствором оксида серебра
5) реагирует с уксусной кислотой
6) окисляется гидроксидом меди (II)
В9 К раствору хлорида кальция массой 140 г с массовой долей 5% добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна
____________ %. (Запишите число с точностью до десятых.)
В10 Какой объем (н. у.) сероводорода выделился при взаимодействии 0,3 моль сульфида железа (II) с избытком соляной кислоты?
(Запишите число с точностью до сотых.)
Для записи ответов на задания этой части (С1–С5) используйте бланк ответов № 2. Запишите сначала номер задания (С1, С2 и т.д.), а затем полное решение. Ответы записывайте четко и разборчиво.
С1 Используя метод электронного баланса, составьте уравнение реакции
I2 + K2SO3 + … → K2SO4 + …+ Н2О.
Определите окислитель и восстановитель.
Напишите уравнения четырех возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
ЧАСТЬ 1
За правильный ответ на каждое задание части 1 ставится 1 балл.
Если указаны два и более ответов (в их числе правильный), неверный ответ или ответ отсутствует – 0 баллов.
| No задания | Ответ | No задания | Ответ | No задания | Ответ |
| А1 | 2 | А11 | 2 | А21 | 1 |
| А2 | 1 | А12 | 1 | А22 | 4 |
| А3 | 4 | А13 | 4 | А23 | 2 |
| А4 | 2 | А14 | 2 | А24 | 3 |
| А5 | 1 | А15 | 4 | А25 | 3 |
| А6 | 4 | А16 | 1 | А26 | 2 |
| А7 | 3 | А17 | 2 | А27 | 2 |
| А8 | 2 | А18 | 3 | А28 | 1 |
| А9 | 2 | А19 | 3 | А29 | 4 |
| А10 | 1 | А20 | 4 | А30 | 4 |
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ в заданиях В1–В8 ставится 2 балла, допущена одна ошибка – 1 балл, за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
За правильный ответ в заданиях В9 и В10 ставится 1 балл, за неверный ответ или его отсутствие – 0 баллов.
КРИТЕРИИ ПРОВЕРКИ И ОЦЕНКИ ВЫПОЛНЕНИЯ ЗАДАНИЙ С РАЗВЕРНУТЫМ ОТВЕТОМ
За выполнение заданий ставится: С1 – от 0 до 3 баллов; С2, С4 – от 0 до 4 баллов; С3 – от 0 до 5 баллов; С5 – от 0 до 2 баллов.
C1
| Баллы | Содержание верного ответа и указания к оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
| Элементы ответа: 1) составлен электронный баланс: 2) расставлены коэффициенты в уравнении реакции: I2 + K2SO3 + 2KOH = 2KI + K2SO4 + H2O; 3) указано, что сера в степени окисления +4 является восстановителем, а йод в степени окисления 0 – окислителем. |
|
| 3 | Ответ правильный и полный, включает все названные выше элементы. |
| 2 | В ответе допущена ошибка только в одном из элементов. |
| 1 | В ответе допущены ошибки в двух элементах. |
| 0 | Все элементы ответа записаны неверно. |
| 3 | Максимальный балл |
| Баллы | Содержание верного ответа и указания к оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
| Элементы ответа: написаны четыре уравнения возможных реакций между указанными веществами: 1) K2Cr2O7 + 2H2SO4 = 2CrO3 + 2KHSO4 + H2O; 2) K2Cr2O7 + 2RbOH = Rb2CrO4 + K2CrO4 + H2O; 3) NaF + H2SO4 = NaHSO4 + HF; 4) H2SO4 + 2RbOH = Rb2SO4 + 2H2O; |
|
| 4 | Правильно записаны 4 уравнения возможных реакций. |
| 3 | Правильно записаны 3 уравнения реакций. |
| 2 | Правильно записаны 2 уравнения реакций. |
| 1 | Правильно записано 1 уравнение реакции. |
| 0 | Все элементы ответа записаны неверно. |
| 4 | Максимальный балл |
| Баллы | Содержание верного ответа и указания к оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
| Элементы ответа: составлены уравнения реакций, соответствующие схеме превращений: 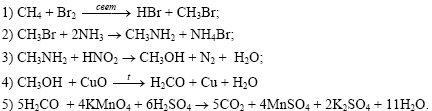 |
|
| 5 | Ответ правильный и полный, включает все названные выше элементы. |
| 4 | Правильно записаны 4 уравнения реакций. |
| 3 | Правильно записаны 3 уравнения реакций. |
| 2 | Правильно записаны 2 уравнения реакций. |
| 1 | Правильно записано 1 уравнение реакции. |
| 0 | Все элементы ответа записаны неверно. |
| 5 | Максимальный балл |
| Баллы | Содержание верного ответа и указания к оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
| Элементы ответа: 1) записано уравнение реакции, и рассчитаны количества исходных веществ: KNO2 + NH4Br = N2↑ + KBr + 2H2O, n(KNO2) = 8,5/85 = 0,1 моль, n(NH4Br) = 270·0,12/98 = 0,33 моль − в избытке, 2) рассчитан объем выделившегося азота: n(N2) = n(KNO2) = 0,1 моль, V(N2) = 0,1 моль · 22,4 л/моль = 2,24 л, 3) рассчитана масса бромида аммония, оставшегося в избытке: n(NH4Br)изб = 0,33 − 0,1 = 0,23 моль, m(NH4Br)изб = 0,23 · 98 = 22,54 г, 4) рассчитана массовая доля бромида аммония: mp-pa = 8,5 + 270 − 0,1·28 = 275,7 г, w(NH4Br) = 22,54/275,7 = 0,0818 или 8,2%. |
|
| 4 | Ответ правильный и полный, включает все названные выше элементы. |
| 3 | В ответе допущена ошибка в одном из названных выше элементов. |
| 2 | В ответе допущена ошибка в двух из названных выше элементов. |
| 1 | В ответе допущена ошибка в трех из названных выше элементов. |
| 0 | Все элементы ответа записаны неверно. |
| 4 | Максимальный балл |
| Баллы | Содержание верного ответа и указания к оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
| Элементы ответа: 1) составлено уравнение реакции: СnН2n-2 + 2НВr → СnН2n Вr2 ; 2) рассчитана молярная масса углеводорода и продукта реакции: М(Сn Н2n-2) = 14n – 2; М(Сn Н2nВr2) = 14n + 160; 3) установлена молекулярная формула углеводорода: (14n + 160)/(14n – 2) = 4, n = 4; Формула: С4Н6. |
|
| 2 | Ответ правильный и полный, включает все названные выше элементы. |
| 1 | Правильно записан первый или второй элементы ответа. |
| 0 | Все элементы ответа записаны неверно. |
| 2 | Максимальный балл |